隨著引領第二次生物醫藥產品浪潮的“單克隆抗體”的出現,抗體圈的一切正在慢慢改變……,在抗體工程藥物中,腫瘤抗體藥物更是異軍突起,獨占一半天下,單克隆抗體藥物以其獨特的作用機制及高效性,在抗惡性腫瘤的治療中發揮了不可估量的重要作用。目前,單克隆抗體已廣泛應用于腫瘤的臨床治療,本文主要從抗體藥物的發展、面臨的挑戰以及如何解決等方面進行了詳細的分析。
抗體藥物的前世今生
和各種重大革命性技術的發展一樣,抗體的研究也是經歷了漫長歲月。直到Kohler和Milstein在1975年創建了淋巴細胞的雜交瘤技術并獲得了專一識別抗原位并與之特異結合的單克隆抗體,才受到了相關領域學者們的高度重視。兩位科學家因此被授予1984年的諾貝爾生理學或醫學獎。

Kohler(右)和Milstein(左)
然而,由于通過雜交瘤技術制備的單克隆抗體是鼠源性的,應用于人體不可避免地引起人抗鼠抗體(HAMA)反應,限制了單克隆抗體的臨床應用。
為了克服這種缺陷,20世紀80年代中期研究者們尋求以基因工程技術對鼠源性單克隆抗體進行改造,嘗試對其人源化處理。如將鼠源抗體可變區與人抗體恒定區拼接而形成嵌合抗體或將鼠抗體可變區的互補決定區(CDR區)與人的抗體的互補決定區互換構成人源化抗體等。
以上抗體技術的建立,基本解決了抗體藥物異源性的問題,促進了抗體藥物的廣泛應用。迄今美國FDA已經批準上市了幾十種治療性抗體藥物,抗體產業增長迅猛,產生了巨大的社會效益和經濟效益。目前國內外處于臨床前、臨床研究的各類生物技術藥物中也以抗體類制品最多,其中則以抗腫瘤抗體藥物最多。
這其中除了單抗之外,新型抗體的開發也各施所長,其中包括雙特異性抗體以及抗體偶聯藥物(ADC)。就開發熱點而言,當然要數PD-1/PD-L1單抗、ADC藥物、以及雙特異性抗體了。目前,全球抗體藥物產業已經步入了強勁發展的時代,與此同時,抗體技術的發展也面臨著諸多挑戰。無論是在抗體靶標和新抗體基因發現,還是在新抗體藥物的研發和產品種類等方面,很多問題都亟待解決。在此,小編做了詳細的總結。主要分為以下幾個方面。
篩選腫瘤治療新靶點
與傳統的小分子藥物相比,抗體的靶點數量相對要少的很多。這主要首先由于抗體本身的性質。一般來說,抗體分子的分子量較大,結構復雜,絕大多數抗體只能對位于細胞膜表面及分泌出來的分子發揮作用,而對于細胞內的分子則很難產生功效。
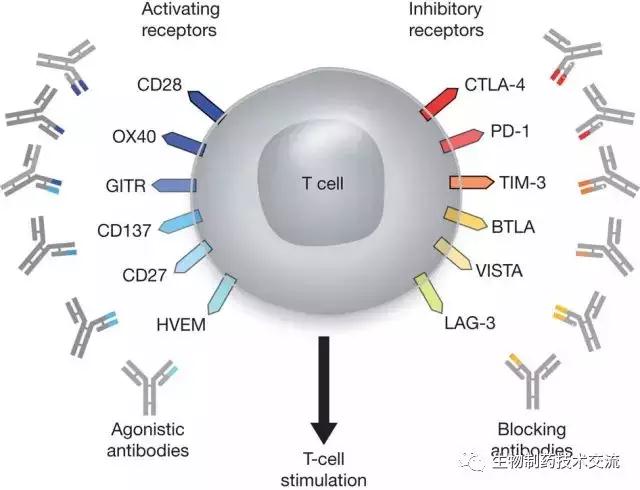
針對不同靶標的抗體
目前,在已經批準的抗體藥物中僅有27個靶標。其中7個靶標分別有兩個或兩個以上的抗體藥物,共計18個。其中5個靶標(TNF、CD20、VEGF、HER2、EGFR)所對應的抗體藥物多數為重磅炸彈藥物,共計10個。在2014-2017新上市的抗體中,幾個特殊靶點已引發重大波瀾,諸如CTLA-4、PD-1/PD-L1等都成了重磅炸彈的誕生地。其中以PD-1/PD-L1為靶點的抗體作為腫瘤免疫治療中的先鋒隊更是各個公司追逐的熱點。
多家國際巨頭公司已在該領域做了充足的準備,包括輝瑞,安進,賽諾菲,再生元、羅氏、諾華、禮來、阿斯利康等。該靶點也必然引起新一輪的腥風血雨。但總體來說,抗體靶標十分有限,所以說,在研發的候選抗體藥物中,新靶點和新適應證抗體是藥物研發團隊首要追求的目標;其次是老靶點的深度開發。
降低抗體的免疫原性
最早通過雜交瘤技術制備的鼠源性單克隆抗體,應用于人體會不可避免地引起人抗鼠抗體(HAMA)反應。隨著基因工程技術的發展,研究人員開始對鼠源性單克隆抗體進行改造,嘗試對其人源化處理以解決單克隆抗體的這種缺陷。可分為嵌合抗體、人源化抗體或完全人抗體。試圖通過增加其可變區序列與人胚系基因的同源性來降低它們的預期免疫原性。
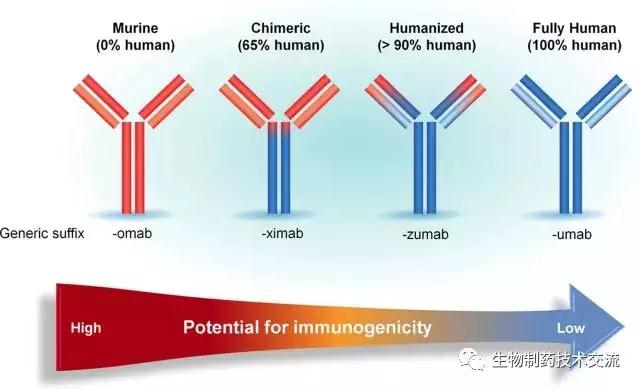
鼠源性到完全人源化抗體
嵌合抗體成功的例子包括羅氏公司的抗 CD20 抗體Rituxan,其用于治療B 淋巴瘤。它的抗淋巴瘤作用主要來自于補體作用、ADCC作用和誘導腫瘤細胞凋亡。因為人鼠嵌合抗體僅僅消除了鼠源單抗的部分異源性,未經改造的可變區的鼠源序列依然可以誘導人體產生HAMA反應,因此對鼠源抗體可變區的進一步進行人源化改造是必然趨勢。
通過研究大量小鼠抗體可變區序列,截取可變區中與抗原直接接觸的序列與人抗體可變區的框架區嫁接,經過親和力重塑,可在極大程度上保持親本抗體的特異性和親和力,同時在人鼠嵌合抗體的基礎上進一步消除免疫原性和毒副作用。人源化抗體成功的例子包括羅氏的Herceptin,其用于治療HER-2過度表達的轉移性乳腺癌。
不容置疑,完全人源化抗體絕對是最理想抗體,其可以達到完全避免鼠源性單抗的種種缺點。目前主要通過抗體庫技術以及轉基因小鼠技術等方法來進行生產。
新型抗體藥物
抗體偶聯藥物(ADC)、雙特異性抗體以及PD-1/PD-L1單抗絕對算的上是抗體圈的明星產品了。
ADC由單克隆抗體與有治療作用的小分子藥物兩部分構成,借助抗體實現化學藥物對腫瘤組織的靶向遞送。ADC 在血液中穩定性高,藥物分子不會脫落,因而毒副作用較小,但對腫瘤細胞的抑制作用遠遠高于裸抗體。這種設計策略既可提高抗體藥物的殺傷能力,又提高小分子化學藥物的治療窗。
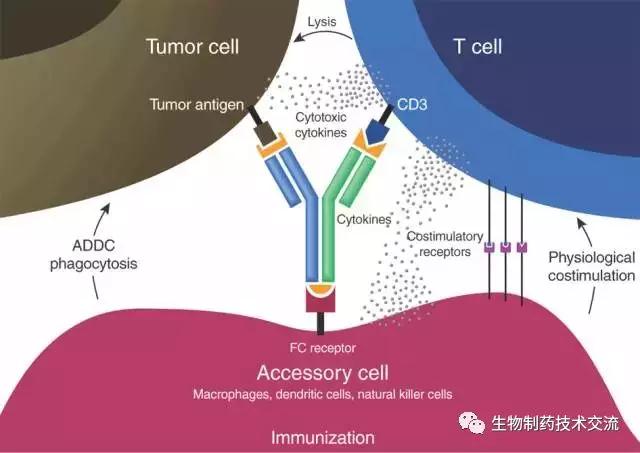
雙特異性抗體
傳統抗體藥物通過封閉單一信號通路抑制腫瘤生長,臨床上易出現抗體藥物的耐藥性。所以雙特異性抗體(BsAb)應運而生,其通過基因工程手段將兩個分別靶向不同抗原的抗體片段組合在一起,具有兩種抗原結合位點,可以發揮協同作用,進而提高治療效果。這種結構設計能有效地改善抗體藥物在體內的藥物代謝動力學過程,增強臨床治療效果。然而,設計出療效好、穩定性高且利于生產的BsAb仍需深入研究。
除了ADC和BsAb之外,腫瘤免疫治療抗體藥物也是火的不行。近幾年,針對免疫檢驗點的PD-1/PD-L1單抗治療不斷在癌癥治療中取得突破性進展,尤其在黑色素瘤、肺癌、腎癌及膀胱癌等多種腫瘤的治療中顯示出很好的療效,初步實現了利用免疫方法治療腫瘤的夢想。
抗體組技術和抗體組藥物
抗體組技術是在基因組學和蛋白組學基礎上,結合雜交瘤技術及基因工程抗體技術,經過抗體靶標高通量篩選、建立大規模抗體庫,最終走向應用。相比傳統的單克隆抗體技術相比,抗體庫技術,具有庫容量大、可篩選種類多、更易獲得針對特定抗原表位的高活性單克隆抗體等無以替代的優勢。同時抗體庫技術在篩選過程中,更為省時、省力、高效、經濟。
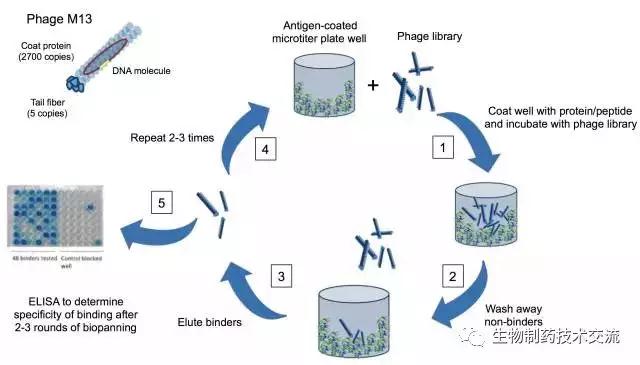
抗體庫技術
目前抗體庫根據其宿主免疫狀態來說,主要分為天然庫和免疫庫兩大類。天然庫從理論上來說可以篩選獲得可與任何抗原特異結合的的抗體,同時人抗體庫可以直接產生全人的抗體V區基因,避免了后續的繁瑣的人源化過程,但這些天然抗體基因缺乏體內的重排與突變過程,因而很難獲得高親和的抗體,所篩選的抗體往往需要進一步的親和力成熟改造,而且同時篩選背景較高,針對特定抗原的抗體豐度低。
相比較而言,免疫庫中則含有大量針對該特定抗原的抗體,其篩選背景大大降低,并且這些抗體基因經過在宿主體內的成熟過程,往往具理想的親和力。
小鼠目前依然是最容易進行免疫和其后續進行基因工程操作的動物品種,然而通過小鼠抗體庫獲得的依然是鼠抗體V區基因,想使其安全用于臨床,還必須進行后續的人源化改造。近兩年發展的全人抗體的轉基因小鼠技術,使得我們可以通過轉有全套人抗體基因的轉基因小鼠來制備人的免疫抗體庫,并從中直接篩選具有治療價值全人的抗體V區基因,無需人源化的改造。
國內抗體藥物產業如何突破瓶頸
在全球抗體藥物產業強勁發展的浪潮中,國內抗體藥物產業也已經實現了從基礎研究到產業化的跨越,抗體的產品逐漸增多,市場逐漸擴大。盡管我國抗體藥物產業近年來發展迅速,但國產抗體藥物的技術水平及市場占有率與國際先進水平仍有較大差距。
中國抗體藥物上市以及原始創新產品開發都面臨著嚴重不足的問題。無論是已上市銷售的還是正在注冊研究的抗體藥物,國內企業在抗體靶標和新抗體基因發現、新抗體藥物創制、產品種類等諸多方面都亟待提升。
Custom mAb
要實現抗體藥物產業發展的突破,應該結合抗體藥物相關的產學研醫用現狀資源稟賦及醫療服務的需求,選定未來重點發展領域及其對應的產品方向,重點支持和引導相關領域目標性抗體藥物產品的開發。加強研發平臺建設、提升抗體藥物自主研發、CRO、CMO及產業化水平,達到與歐美先進國家同步,打破國外醫藥巨頭對我國抗體藥物的市場壟斷,增強我國在國際抗體藥物領域的綜合競爭優勢。


